近日,骨科研究所陈亮教授、顾勇副教授、郗焜博士团队的论文“immune-defensive microspheres promote regeneration of the nucleus pulposus by targeted entrapment of the inflammatory cascade during intervertebral disc degeneration”在bioactive materials上在线发表。陈亮教授团队的研究生周亮为论文第一作者,陈亮教授、顾勇副教授及郗焜博士为论文的通讯作者。
椎间盘退变是引起腰背疼痛的最主要原因之一,容易致残并且严重影响患者生活质量,带来大社负担。长期的慢性炎症是椎间盘退变的显著特点之一,椎间盘髓核、纤维环细胞自身分泌的炎性细胞因子例如肿瘤坏死因子α(tnf-α)、白细胞介素家族水平升高是椎间盘退动因素。多数生物拮抗剂,在体内半衰期短,易被快速清除,单一的细胞因子拮抗剂不足以应对椎间盘内复杂多变的免疫微环境。亟需设计多效价、持续释药的生物材料用以治疗椎间盘退变
仿生生物膜伪装技术(cmc)近年在各个领域得到广泛应用,作为一种新颖的自上而下的合成方法,cmc技术可将天然细胞膜可完整地转移到纳米颗粒底物上,保留生物质膜的脂质、相关表面蛋白质以及糖类,细胞膜涂层赋予了纳米颗粒独特的生物学功能和复杂的表面化学性质。通过膜蛋白介导的受体-配体相互作用,cmc材料继承了主动靶向的细胞性能,可模拟部分免疫细胞功能,实现多效价炎症因子吸附,有效抑制局部微环境中的过度炎症进展,通过细胞膜涂层表面膜蛋白介导的受体-配体效应,cmc材料可模拟部分细胞功能,实现对目标细胞的高效主动靶向、组织浸润、炎症调控,有望被应用于炎症性疾病的治疗。
嗜中性粒细胞是固有免疫系统的重要组成,对于炎症刺激具备高度敏感性,通常是第一批被募集至炎症部位的免疫细胞。其通过表面整合素β,巨噬细胞表面分子抗原(mac-1),淋巴细胞功能抗原1(lfa-1)等表面抗体的表达,使得嗜中性粒细胞得以特异性趋化至炎症部位,在应对炎症微环境与组织损伤方面发挥着重要作用。通过嗜中性粒细胞膜涂层包被,可赋予生物材料与椎间盘退变中进程中炎症环境的交互潜能。
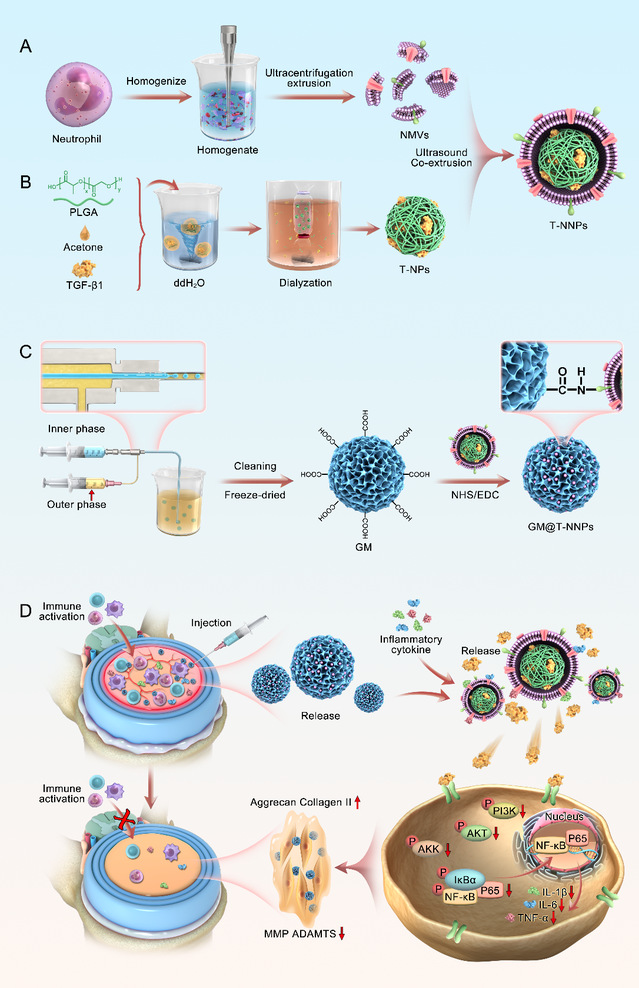
基于椎间盘退变中,过度炎症诱发的细胞外基质合成分解代谢失衡,募集免疫细胞,激活炎症级联反应,介导组织损伤的病理特点,陈亮教授团队开发了嗜中性粒细胞膜功能化的可注射水凝胶微球(gm@t-nnps),将嗜中性粒细胞膜涂层修饰的载药plga纳米粒(t-nnps)与gelma水凝胶微球接枝,开发了“炎症伪装”复合体微球。gm@t-nnps可发挥免疫防御功能,持续释放t-nnps广谱炎症因子抑制剂,作为免疫细胞竞争性抑制剂,在减轻局部过度炎症、减缓免疫细胞局部募集的同时,长效释放转化生长因子tgf-β1,并阻断下游炎症途径激活引发的炎症级联,展现了恢复椎间盘环境中细胞外基质积累,促进髓核再生的巨大潜力。
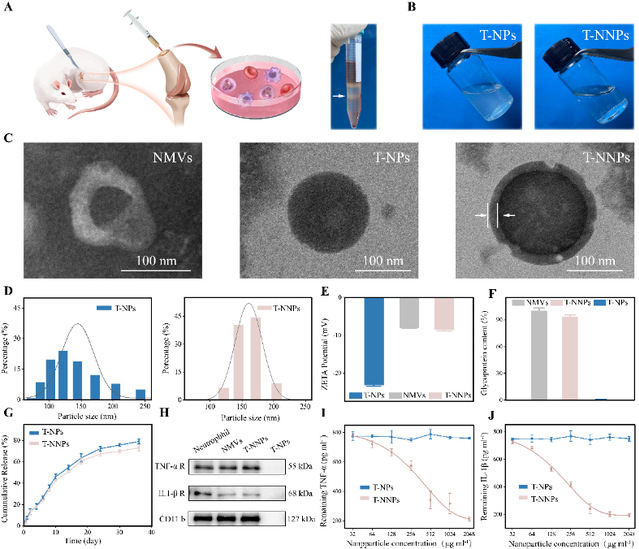
利用纳米沉淀法成功制备了负载tgf-β1的plga纳米颗粒t-nps。在骨髓悬液制备、密度离心步骤之后,提纯了嗜中性粒细胞,应用超速离心法收集质膜。嗜中性粒细胞膜与纳米内核在超声共浴、脂质体挤出后获得了细胞膜仿生纳米粒t-nnps,透射电镜下验证了t-nnps纳米颗粒的球壳结构。western blot展示了t-nnps膜蛋白受体在细胞膜的分离纯化和细胞膜与纳米内核的组装过程中得以有效保留。酶联免疫吸附试验验证了细胞膜涂层赋予纳米颗粒的改善tgf-β1药物释放动力学,并且有效吸附游离炎症因子的双重功能。
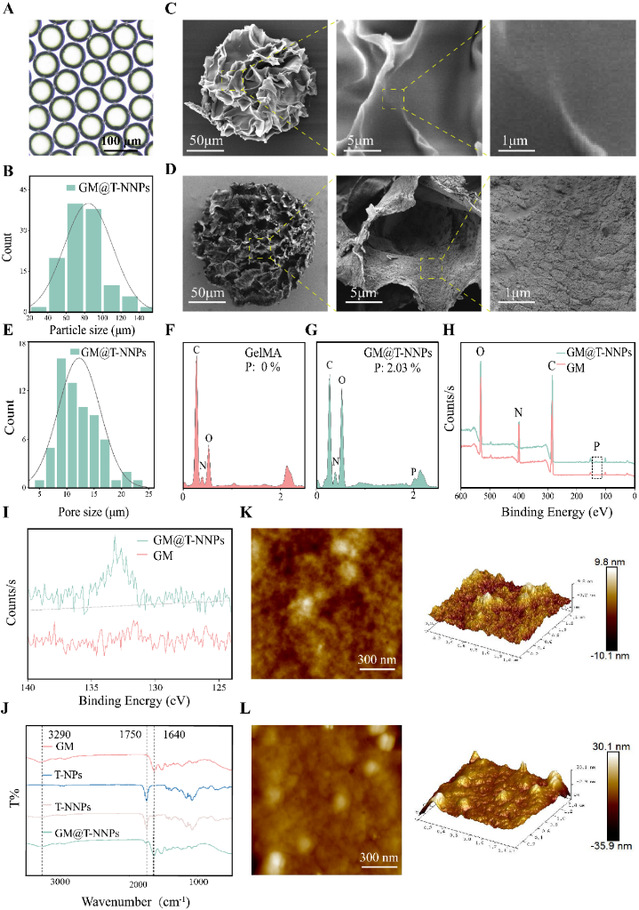
经过扫描电镜观察,可观测到gelma微球表面具备丰富的孔隙,因此gm水凝胶微球可作为合适的载体材料。能谱分析(eds)和x光电子能谱分析(xps)验证了纳米颗粒接枝之后的gm@t-nnps表面p元素的存在,傅里叶红外光谱证明了gm@t-nnps表面存在plga特征性的c=o峰存在,进一步验证了共价化学接枝的成功。原子力显微镜afm探索了化学接枝前后微球的粗糙程度及力学性能,可以发现接枝后的纳米粒-微球复合体表面粗糙程度ra上升。
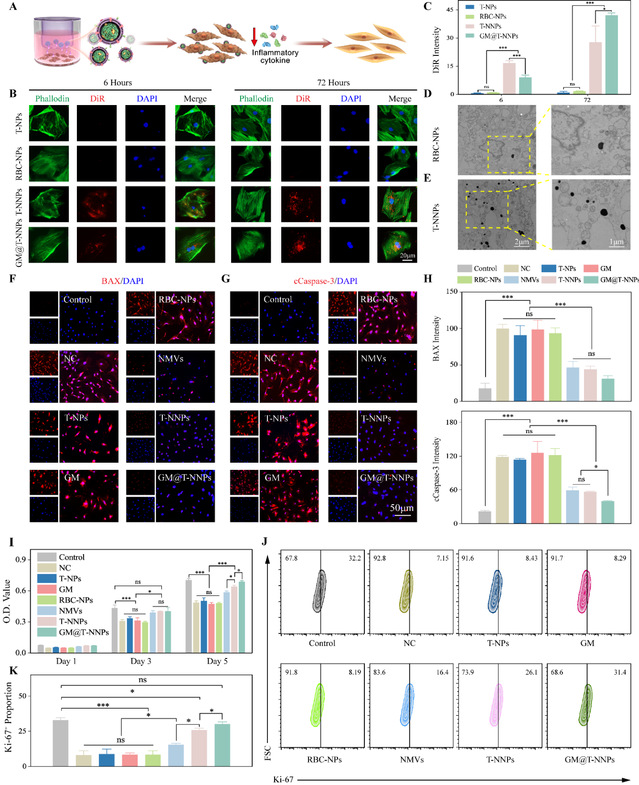
在transwell体系下验证纳米颗粒的炎症靶向趋化能力,裸露的t-nps内核组中可观察到极少有纳米颗粒在髓核细胞表面粘附、或被髓核细胞内化。而在t-nnps以及gm@t-nnps组中,则有更多的纳米颗粒被内吞。生物冷冻透射电镜观察进一步验证了该实验结果,在t-nnps干预的髓核细胞内,可以观察到更多的纳米颗粒存在。细胞膜表面的炎症细胞因子受体介导了t-nnps纳米颗粒向炎症部位的靶向趋化过程。
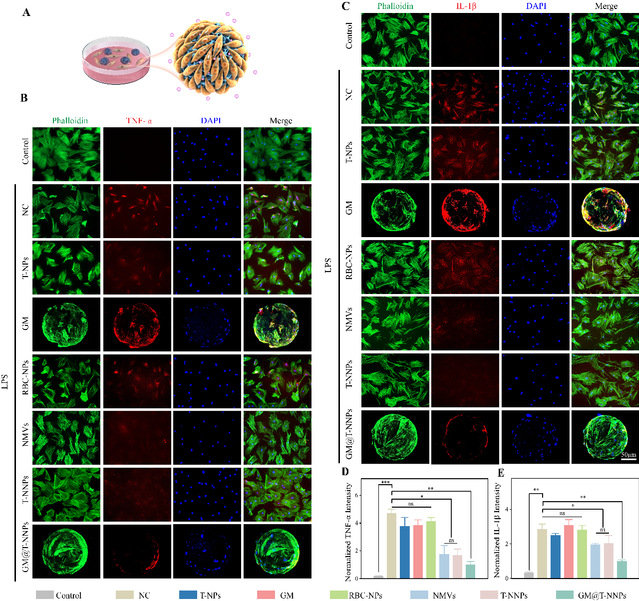
建立髓核细胞共培养体系,通过体外实验评价gm@t-nnps作为广谱抗炎材料调节局部炎症微环境功能。相较于nc组, gm@t-nnp中tnf-α荧光强度分别下降了78.9%,il-1β荧光强度分别下降了64.6%,证实了防御体微球的促炎细胞因子的负性调控功能,展示了gm@t-nnps介导的高效炎症因子吸附效能。
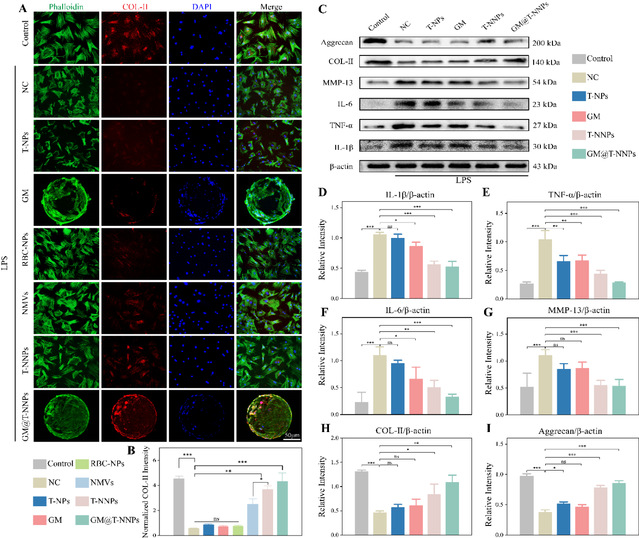
另一方面,ii型胶原是细胞外基质ecm的重要组成部分,可作为评估ecm分解和髓核退变程度的指标。gm@t-nnps有效抑制局部过度炎症后,col-ii蛋白表达明显上调,荧光强度是nc组的7.50倍。gm@t-nnp通过多效炎症因子吸附及转化生长因子释放,显著改善炎症微环境,维持细胞外基质蛋白分泌。
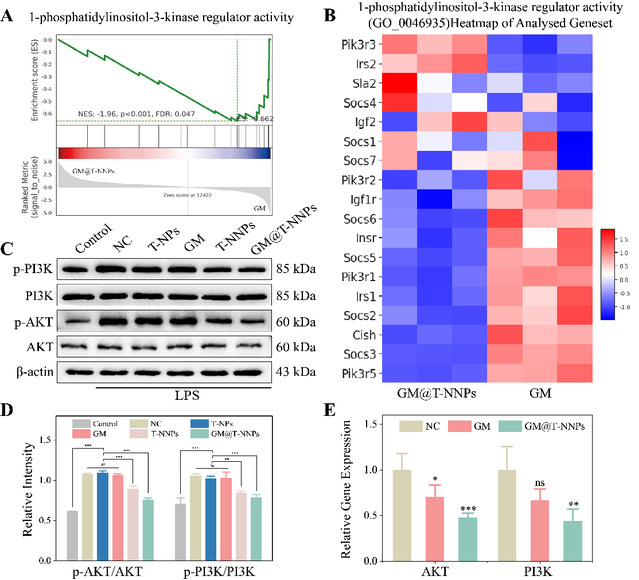
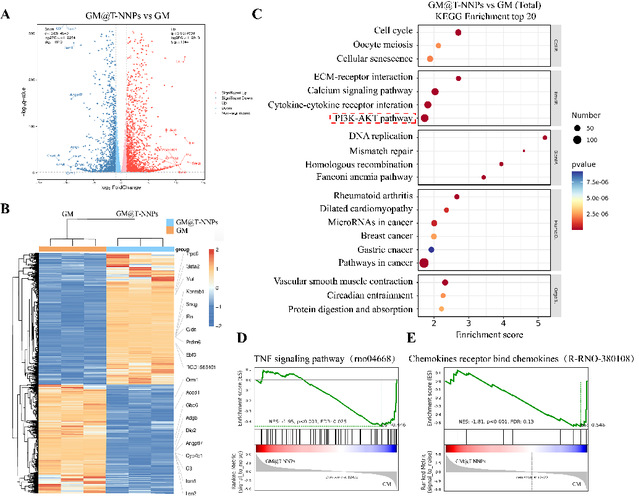
通过转录组基因测序技术,该研究探究了gm@t-nnps治疗椎间盘退变的潜在分子机制。go富集分析展示了,细胞粘附和免疫应答显著下调,ecm结构成分相关基因表达显著上调;kegg富集分析揭示了tnf信号通路、趋化因子结合途径和炎症迁移相关的基因表达水平下降以及pi3k-akt信号通路的抑制与其治疗效果相关。
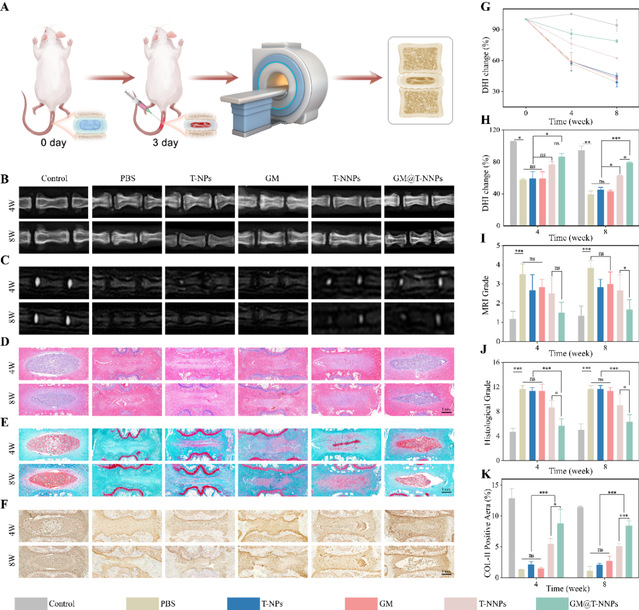
为了验证复合微球在体内治疗效果,该研究建立了大鼠尾椎穿刺模型。利用影像学检查以及组织学切片对于椎间盘退变及再生的情况进行验证。单纯水凝胶微球及t-nps很难挽救穿刺后塌陷的椎间盘高度,在磁共振t2序列当中,pbs组、t-nps组以及gm组中髓核组织的高水合特性消失。t-nnps以及gm@t-nnps的治疗则挽救了一部分髓核生理功能的丧失。组织学切片进一步验证了各组材料在体内的治疗效果。穿刺后的pbs组中,髓核细胞数量骤减,且与周围纤维环组织界限更为模糊,椎间盘高度下降,髓核组织被瘢痕纤维替代。h&e染色以及番红固绿染色显示,t-nps与gm治疗组中的髓核组织形态接近pbs组,并没有明显的髓核组织恢复。t-nnps以及gm@t-nnps则可以观察到显著的髓核组织再生,同时col-ii阳性髓核细胞数量上调。
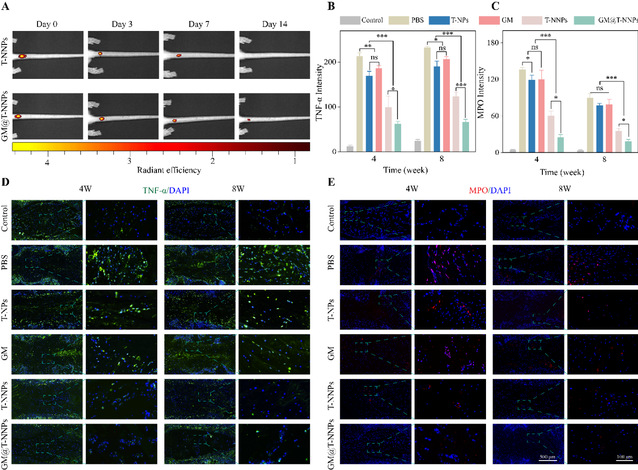
针对纳米颗粒材料与微球材料在注射原位的留置效率,该研究利用小动物成像仪观察了cy5标记的t-nnps和gm@t-nnps在注射后的留置效率。注射后3天时进行观察可以发现,t-nnps较第0天时荧光强度显著下降,而gm@t-nnps组下降幅度较小,t-nnps在注射后早期的荧光强度下降更符合材料渗漏的特点。因此gm@t-nnps的构建使得t-nnps能在椎间盘环境中更稳定的释放和留置,提升了材料的体内稳定性。
体内免疫荧光染色进一步验证了gm@t-nnps复合体在体内的炎症调控、免疫调控性能。mpo染色展示了生理状态下,前纵韧带、后纵韧带、上下终板组成的生物屏障使得椎间盘成为相对免疫豁免环境,阻止了免疫细胞在髓核环境中的富集。而在穿刺过后的pbs组,gm组、t-nps组中,生物屏障的破坏以及小血管生成为免疫细胞的浸润富集提供了通道,gm@t-nnps的存在使得类细胞的纳米颗粒t-nnps得以持续释放,作为免疫细胞诱饵,与外周免疫细胞形成竞争性抑制,使得4周、8周时his48的嗜中性粒细胞以及f4/80的巨噬细胞的数量减少,从而下调了免疫细胞在椎间盘环境中的炎症级联反应,进而缓解了椎间盘退变进程。
仿生生物膜伪装技术结合了天然仿生材料与合成材料的优势,通过将功能化的纳米内核与天然细胞膜材料装配,构建了一种“自上而下”的合成策略。该研究针对椎间盘退变设计、整合了嗜中性粒细胞功能化的纳米颗粒与gelma 水凝胶微球,使得具备吸附-释放双重功能的纳米颗粒在体内实现长期稳定的释放,实现高效炎症吸附,作为炎症诱饵,与外周免疫细胞发生竞争性抑制,下调免疫细胞在椎间盘环境中的募集,进而减弱了下游炎症级联反应的发生,为慢性炎症性疾病的治疗提供了一种新思路。
文章题目:immune-defensive microspheres promote regeneration of the nucleus pulposus by targeted entrapment of the inflammatory cascade during intervertebral disc degeneration.
文章网址:https://doi.org/10.1016/j.bioactmat.2024.03.020

